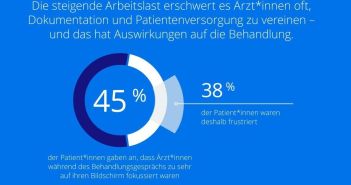
Die US-amerikanische Food and Drug Administration (FDA) hat die Fast Track-Zulassung für das Medikament BNT325/DB-1305 erteilt. Dieses Medikament wurde entwickelt, um Patienten mit platinresistentem Eierstockkrebs, Eileiterkrebs oder primärem Bauchfellkrebs zu behandeln, die zuvor ein bis drei systemische Behandlungsregime erhalten haben. BNT325/DB-1305 ist ein ADC-Kandidat der nächsten Generation, der das Trophoblastzell-Oberflächenantigen 2 (TROP2) als Zielmolekül hat. TROP2 ist ein Protein, das auf verschiedenen Tumortypen überexprimiert wird. Derzeit wird BNT325/DB-1305 in einer laufenden Phase-1/2-Studie bei Patienten mit TROP2-exprimierenden fortgeschrittenen soliden Tumoren evaluiert.
Inhaltsverzeichnis: Das erwartet Sie in diesem Artikel
Fast Track-Zulassung für vielversprechende Behandlung von Eierstockkrebs
Eierstockkrebs ist eine häufige und schwerwiegende Erkrankung, die weltweit viele Frauen betrifft. Mit über 300.000 Fällen pro Jahr gehört er zu den am häufigsten diagnostizierten gynäkologischen Tumoren. Die meisten Eierstocktumore entstehen aus Epithelzellen und werden oft erst in fortgeschrittenen Stadien erkannt, was die Prognose für die Patienten erschwert. Leider ist Eierstockkrebs eine der häufigsten Todesursachen bei Frauen. Die Überlebensrate variiert je nach Stadium der Erkrankung, liegt jedoch im Durchschnitt zwischen 26% und 42% über einen Zeitraum von 5 Jahren.
FDA erteilt Fast Track-Zulassung für vielversprechenden ADC-Kandidaten zur Behandlung von platinresistentem Eierstockkrebs
Die Zulassung von BNT325/DB-1305 durch die FDA ist eine wichtige Bestätigung für das vielversprechende Potenzial dieses ADC-Kandidaten. Platinbasierte Chemotherapie ist derzeit die Standardbehandlung für Eierstock-Epithelkrebs und verwandte Subtypen. Allerdings haben Patienten mit Platinresistenz eine schlechte Prognose und es besteht ein dringender Bedarf an effektiven und gut verträglichen Behandlungsmöglichkeiten. Studien haben gezeigt, dass TROP2 eine wichtige Rolle beim aggressiven Wachstum und Fortschreiten von Eierstocktumoren spielt. Die weitere Entwicklung von BNT325/DB-1305 zielt darauf ab, diese Einschränkungen bei der Behandlung von fortgeschrittenem Eierstockkrebs zu überwinden.
FDA erteilt Fast Track-Zulassung für BNT325/DB-1305 bei platinresistentem Eierstockkrebs
BNT325/DB-1305 wurde als zweite Untersuchungssubstanz in der strategischen Zusammenarbeit zwischen BioNTech SE und Duality Biologics (Suzhou) Co., Ltd. entwickelt. Die Substanz hat von der US-amerikanischen Food and Drug Administration (FDA) die Fast Track-Zulassung erhalten, was bedeutet, dass sie das Potenzial hat, einen medizinischen Bedarf zu decken, der bisher nicht ausreichend abgedeckt wurde. Dies ist ein wichtiger Schritt in der Behandlung von platinresistentem Eierstockkrebs und anderen verwandten Krebsarten.
Die klinische Phase-1/2-Studie mit BNT325/DB-1305 lieferte vielversprechende Ergebnisse bei stark vorbehandelten Patienten mit TROP2-exprimierenden soliden Tumoren. Trotz Versagens der Standardtherapie erreichte der ADC eine objektive Ansprechrate von 30,4% und eine Krankheitskontrollrate von 87,0%. Dies bestätigt das Potenzial von BNT325/DB-1305 und motiviert uns, die Entwicklung im Rahmen des Fast Track-Programms voranzutreiben. Unser Ziel ist es, die Behandlungsergebnisse für eine breite Palette von Patienten zu verbessern.
FDA erteilt Fast Track-Zulassung für vielversprechendes Krebsmedikament BNT325/DB-1305
Der Fast Track ist ein beschleunigtes Verfahren zur Entwicklung und Überprüfung neuer Medikamente und Impfstoffe, die zur Behandlung schwerwiegender Erkrankungen bestimmt sind. Diese Zulassung basiert auf vorläufigen Daten einer laufenden Studie mit dem Medikament BNT325/DB-1305 bei Patienten mit platinresistentem Eierstockkrebs. Durch die Fast Track-Zulassung kann die FDA eng mit den Entwicklern zusammenarbeiten, um den Zulassungsprozess zu beschleunigen und die Behandlungsoptionen für Patienten zu verbessern.
Neue Generation von ADC mit TROP2 als Zielmolekül entwickelt
BNT325/DB-1305 ist ein vielversprechender ADC der dritten Generation, der auf einem topoisomerase-1-Inhibitor basiert. Das Medikament wurde speziell entwickelt, um das Zelloberflächenprotein TROP2 als Zielmolekül zu haben. TROP2 wird in vielen normalen Geweben exprimiert, ist jedoch bei verschiedenen Tumoren überexprimiert. Die Entwicklung von BNT325/DB-1305 basiert auf der Duality Immune Toxin Antibody Conjugates (DITAC)-Plattform von DualityBio. Mit diesem ADC besteht die Hoffnung, die Behandlungsmöglichkeiten für Patienten mit Tumoren, die TROP2 überexprimieren, zu verbessern.
TROP2 ist ein Zelloberflächenprotein, das eine wichtige Rolle bei der Regulierung des Wachstums und der Ausbreitung von Tumorzellen spielt. Der ADC-Kandidat BNT325/DB-1305 hat in verschiedenen Tumormodellen gezeigt, dass er die Aktivität von TROP2 hemmen kann. Dies deutet darauf hin, dass er das Potenzial hat, das Tumorwachstum zu stoppen und die Prognose von Krebspatienten zu verbessern. Darüber hinaus zeichnet sich BNT325/DB-1305 durch ein gutes Sicherheitsprofil aus und könnte somit eine vielversprechende Option für die Behandlung von soliden Tumoren sein.
Bedeutender Meilenstein: Fast Track-Zulassung für BNT325/DB-1305 bei Eierstockkrebs
Die FDA hat die Fast Track-Zulassung für BNT325/DB-1305 zur Behandlung von platinresistentem Eierstockkrebs und verwandten Krebsarten erteilt. Dies ist ein bedeutender Meilenstein, da die aktuelle Behandlung von fortgeschrittenem Eierstockkrebs oft zu schlechten Prognosen führt. BNT325/DB-1305 ist ein vielversprechender ADC-Kandidat, der das Potenzial hat, die Behandlungsergebnisse zu verbessern, indem er die aktuellen Einschränkungen überwindet. Durch die enge Zusammenarbeit mit der FDA wird die Entwicklung von BNT325/DB-1305 beschleunigt und der Medikamentenzulassungsprozess unterstützt. Dies gibt Hoffnung für Patienten mit platinresistentem Eierstockkrebs und anderen Tumoren, die TROP2 überexprimieren.
Die bisherigen Daten aus klinischen Studien zeigen vielversprechende Ergebnisse bei stark vorbehandelten Patienten, insbesondere eine hohe Ansprechrate und Krankheitskontrollrate. Die Fast Track-Zulassung ermöglicht eine schnellere Entwicklung von BNT325/DB-1305 und eine engere Zusammenarbeit mit der FDA, um den Medikamentenzulassungsprozess zu unterstützen. Dieser vielversprechende Ansatz bietet Hoffnung für Patienten mit platinresistentem Eierstockkrebs sowie anderen Tumoren, die das TROP2-Protein überexprimieren.